关于efreeshare系统v1.0
efreeshare系统是一套专注于生物制药数据标准化执行和管理的应用软件,用以助力临床程序员数据标准化的准备和提交过程,保证临床试验数据准确、合规,符合监管要求,从而加速生物制药研发的总体进程。
该系统提供临床试验数据验证和电子化提交一站式服务,实现高度自动化填充,力求提升国内企业指导标准和行为规范,使用FDA/CDISC等最新标准,实现国际通用行业标准100%国产化,高质量、高标准、高品质保证数据的科学性和安全性,填补国内同类系统空白。
基本功能概述
多格式(如.xpt/.sas7bdat)中、英文临床试验数据验证,验证报告可在线浏览和下载
SDTM、ADaM多格式数据线上浏览和导出
csdrg、adrg在线编辑和下载
Define.xml在线编辑、验证和下载
SDTM、ADaM Mapping Specifications模版在线编辑和下载
注册及登录
1. 进入efreeshare系统官网(efreeshare.com),点击登录按钮,进入注册页面。
2. 手机号注册,获取验证码,按密码强度要求设置密码,阅读“服务协议”,勾选方框,完成注册。
3.注册完成后,回到登录界面,使用手机号和密码登录,进入efreeshare系统。
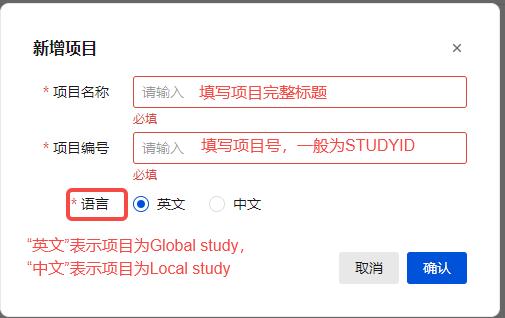
4. 点击“新增项目”,输入项目号和项目标题,创建中文或英文项目。
5. 项目创建完成,点击项目内容,进入系统,按使用说明操作。
efreeshare系统v1.0界面操作详细说明
项目添加:中文项目表示只在中国境内开展的临床试验,采集的数据点基本上为中文字符,英文项目表示在全球范围内开展的临床试验,采集的数据点基本上为英文字符。
项目编号一般为临床试验方案号(如果试验设计不同,有两套EDC数据库,按实际情况需新增两个项目,如一期药理单次剂量爬坡和某剂量多次给药或食物影响研究,可设置Single dose和Multipe dose两个项目;如果是同一个项目分为short-term和long-term,又或者是cut-off、中期分析等原因,由于终究是一套数据,依然认为是一个项目,当然用户也可以按实际需要分阶段提交;如果是ISE/ISS项目,当作2个),项目名称一般为临床试验方案的标题。最后注意,在新增项目的时候,项目名称和项目号不要填反了。
SDTM Mapping Specifications Template
在开始SDTM编程之前,先在线创建SDTM编程说明书模板。点击“新增”,系统将创建基于SDTMIG 3.3和SDTM 1.7标准的空白模板。系统里默认了诸多配置,用户可按实际情况自行修改更新,文档可多用户在线编辑,自动保存,下载,存档等,方便统一管理。同时,我们提供使用此编程说明书的SAS程序代码。
Domain标签囊括所有标准域,点击名称可跳转到相应域,“Source Data Used”列为本域编程使用的EDC数据集和其他可能的外部文件,如果不需要创建相应的域,此列置空。
具体域囊括所有标准变量,在“Conversion Definition”列填写对应变量的mapping方法,如果不需要创建此变量,此列置空。点击“Controlled Terms or Format”列值跳转到对应变量的最新的codelist(如当前最新的版本为2024-03-29),点击“DOMAIN”回到Domain标签。

如5个试验设计数据集通常是需要创建。如Core为“Req”或“Exp”的变量通常进入数据集,不管用户有没有填写mapping rule,这同时也提示了用户需要填写变量相应的计算规则。
数据集上传
基于编程说明协议创建完数据集,上传到系统。我们支持SAS数据集sas7bdat格式的数据直接参与验证,不需要用户频繁地将sas7bdat格式转化成xpt格式,只需在基本确认sas7bdat格式数据为终版时再创建xpt,这在前期验证流程上能节省不少工作时间(可能有的人会说,我可以在每次创建sas7bdat的时候就同时生成对应的xpt文件,这也是要消耗资源的)。
另外,我们同时在efreeshare官网(https://www.efreeshare.com/specification)上传了cdisc官方发布的数据供业界朋友下载,学习和交流。
数据集验证
首先,这里提几点关于数据验证流程的建议:1. 不需要等所有数据集全部完成之后才开始验证,可以边做边验证,有些问题可以提前规避;2. 如果是独立双编程,在另一方QC之前就自行验证发现问题,有的时候双方可能都没有发现数据质量或逻辑问题;3. 数据验证极其重要,是保证数据质量的关键环节,要引起高度重视,尤其是国内临床试验;4. 不可太拘泥于某些验证规则的文字表述,规则也是人为规定的,要结合实际情况,注意灵活掌握和运用,将更多精力放在临床试验本身的安全和疗效属性上面;5. CDISC虽然已经发布SDTMIG 3.4版本,但仍需要行业和监管机构的消化和认可,FDA Data Standards Catalog v8.0 (02-15-2022)也没有提到SDTMIG 3.4开始适用时间,SDTMIG 3.3为当前比较流行和通用的标准。
SDTMIG 3.3数据集验证配置引擎为FDA Validator Rules version 1.6(2022年12月最终版本)和FDA Business Rules version 1.5(2019年5月最终版本),对中文项目的验证也是使用同样的标准,可只验证数据集,也可同时验证数据集和相应的define.xml文件。英文项目可选择相应的配置文件,如标准术语,编码等,中文项目验证标准术语可选择“2024-03-29”版本中文标准术语(注:SDTM标准术语2024-03-29版本由efreeshare开发小组负责完成翻译,校对),如不配置相关验证条件,可选择“Not Applicable”。进report模块查看验证报告。
数据线上查看
数据导出
可以将数据集导出为常规格式的数据供非统计人员使用。

aCRF查看
可在系统内上传pdf格式文件,方便资料之间的查阅,对比,审核。
csdrg文档
系统根据项目语言选择初始化不同的csdrg模板在线创建csdrg文档,中文项目语言为汉字,英文项目语言为英语,模板内容和格式来自Phuse最新发布的Version 1.3,2018-11-01,用户在相应位置填写内容即可。
根据导入的数据自动填充相应内容。
按需插入图片,可调整大小。选择不同的答案(如“是”或“否”),对应不同的回答。
Define-XML
根据FDA Data Standards Catalog - Supported and Required Standards所示,如果项目开始日期在Requrement Begins' date(此处适用Define-XML 2.1要求的开始日期为2023/3/15)之后,则申办方或申请人在提交时为保证合规必须使用指定的标准。我们建议申请人使用Define-XML 2.1版本提交数据。
Define-XML 2.0中,SDTM 变量或变量value-level的origin:type有以下几种:CRF,Protocol,Assigned,Derived;而在Define 2.1中,它是origin:type和origin:source的组合。
SDTM DM Define-XML Version 2.0部分展示
SDTM DM Define-XML Version 2.1部分展示
Origin=CRF在Define-XML从2.0到2.1变化
标准和术语的确定:Version 2.0标准的指定是对整个package,从MetaDataVersion到适用标准的名称和版本。
Define-XML 2.1新“标准”部分
数据集Metadata显示不同的Domain可以有不同的标准
对特定变量使用指定版本的CT,实际项目中一般就用一套。
添加新的子分类(ADaM sub-classes),将合适的ADaM数据集更进一步分类。
空数据集的表示
数据中空变量的表示,系统自动填充相关信息。
页面编辑,详细操作见define操作视频。
